О.С.ЗАЙЦЕВУЧЕБНАЯ КНИГА ПО ХИМИИДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
|
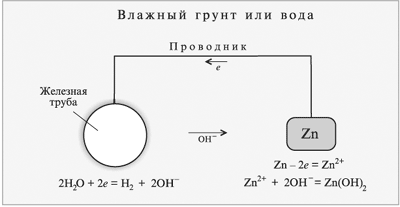 |
|
С той же целью цинковые листы помещают
в котлы с кипящей водой.
Иногда железо покрывают слоем олова (луженое
железо), которое устойчиво к действию воды
или водных растворов некоторых электролитов в
присутствии кислорода воздуха. Поведение
луженого железа в условиях эксплуатации изделия
принципиально отличается от поведения
оцинкованного железа. Повреждение слоя цинка на
железе не приводит к разрушению железа, т. к.
происходит разъедание цинка. Но повреждение слоя
олова приводит к ржавлению железа, при этом само
олово не разъедается.
В случае луженого железа также возникает
гальванический элемент, но направление перехода
электронов в нем иное, чем в случае оцинкованного
железа. Сравним электродные потенциалы железа и
олова:
![]()
Видно, что железо обладает более высокой способностью отдавать электроны, и они будут переходить от железа к олову. Поэтому записываем:
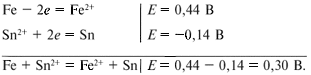
Результаты этого расчета показывают, что олово
не разрушается, а железо превращается в ионы Fe2+.
Проследите далее, что происходит на поверхности
олова и каковы превращения ионов железа.
Олово, получив избыток электронов, в кислотной
среде отдает их ионам водорода, и образуется
молекулярный водород:
2Н+ + 2е = Н2.
В нейтральной или щелочной среде электроны реагируют с молекулами воды, что также приводит к образованию молекулярного водорода:
2Н2О + 2е = Н2 + 2ОН–.
Образовавшиеся ионы Fе2+ в дальнейшем участвуют во многих других реакциях. Они могут взаимодействовать с гидроксид-ионами, образующимися в реакции выделения водорода из воды:
Fе2+ + ОН– = FеОН+,
FеОН+ + ОН– = Fе(ОН)2.
Дигидроксид железа Fе(ОН)2 на воздухе, взаимодействуя с кислородом, переходит в тригидроксид железа Fе(ОН)3:
4Fе(ОН)2 + О2 + 2Н2О = 4Fе(ОН)3.
Ионы Fе2+ могут окисляться на воздухе до ионов Fе3+:
4Fе2+ + O2 + 2Н2О = 4Fе3+ + 4ОН–.
Основным продуктом ржавления железа считают тригидроксид Fе(ОН)3. При удалении воды (высушивание) образуется FeООН, соответствующий составу бурой ржавчины:
Fе(ОН)3 = FeООН + Н2О.
Почему дигидроксид и тригидроксид железа в водном растворе не образуют под действием углекислого газа карбонаты железа?
Ионы Fе2+ могут непосредственно реагировать с углекислым газом или с карбонат-ионами:
Fе2+ +
= FeCO3,
Fе2+ + Н
= FеНСО3+,
Fе2+ + СО2 + Н2О = FеСО3 + 2Н+.
Под действием углекислого газа дигидроксид железа в отсутствие воды может переходить в карбонат железа FeCO3, образуя полезное ископаемое сидерит.
Ответ. Карбонат железа подвергается водой полному гидролизу:FеСО3 + Н2О = Fe(ОН)3 + СО2.
В то же время осно'вные карбонаты железа (FeОН)2СО3 или FeОНСО3 вполне устойчивы в водных средах.
Гальванические элементы образуются не только
при контакте двух различных металлов, но и при
наличии в металле любых участков, отличающихся
друг от друга какими-либо параметрами:
температурой, давлением, плотностью, состоянием
поверхности и т.п. Даже предыстория обработки
металла играет роль в возникновении коррозии.
Расположенные рядом деформированные и
недеформированные участки металла приводят к
возникновению разности потенциалов, и
деформированный участок корродирует сильнее
недеформированного.
Важнейшим показателем коррозии является ее
скорость. По своим стехиометрическим
коэффициентам уравнения реакций коррозии
довольно просты, но по механизму и виду
элементарных стадий коррозия относится к числу
наиболее сложных гетерогенных реакций. Скорость
коррозии определяется скоростью наиболее
медленной в данных условиях стадии, а она по
природе может быть как химической (окисление
металла, переход электронов и т.п.), так и
физической (диффузия электролита, газа,
продуктов коррозии).
Ингибитор замедляет обычно лишь одну из
стадий химического процесса. Из-за
многостадийности процесса коррозии и очень
высокой чувствительности скорости отдельных
стадий даже к незначительному изменению внешних
условий поиск ингибитора и теоретически, и
практически очень затруднен, и часто
положительные результаты обнаруживаются
случайно.
Скорость коррозии выражается различными
единицами измерения. Часто скорость коррозии
оценивают по изменению (потере) массы,
приходящейся на единицу площади поверхности за
некоторый промежуток времени, например г/(мм2•год)
или моль/(см2•год). Иногда за скорость
коррозии принимают уменьшение во времени
толщины изучаемого образца или соответствующую
толщину образовавшегося слоя продукта. Скорость
коррозии может быть выражена плотностью тока,
необходимой для данного изменения массы или
толщины образца за единицу времени. При действии
на металл кислотных сред скорость коррозии может
быть выражена объемом выделяющегося газа за
единицу времени.
Вы убедились, что коррозия является сложнейшей
химической реакций, обладающей огромной и ярко
выраженной многоаспектностью способов ее
обсуждения и предотвращения. Коррозия, как и все
явления природы, зависит от большого числа
факторов: состава вещества, термодинамических и
кинетических характеристик отдельных реакций и
всего процесса в целом, от примесей, состояния
поверхности, климата, географических и
геологических условий эксплуатации изделия и
многого другого. Именно поэтому коррозия, как и
погода или стихийные бедствия, часто
непредсказуема, а результаты лабораторных
экспериментов часто не подтверждаются в
условиях реального использования металла.
Список новых и забытых понятий и слов
| Коррозия; электрохимическая коррозия; оцинкованное и луженое железо; ингибитор коррозии. |