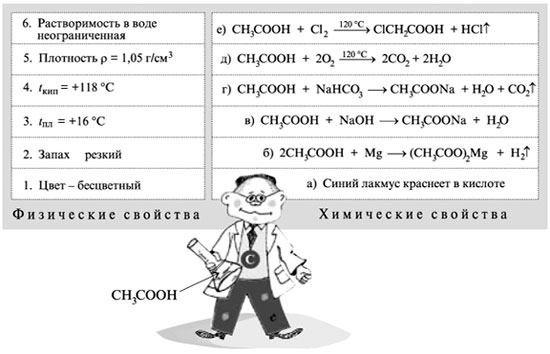
Продолжение. Начало см. в № 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 26, Урок 28.
|
| Вещество | Агрегатное состояние |
Температура плавления, °С |
Температура кипения, °С |
Растворимость в воде |
|---|---|---|---|---|
| Изопропанол | Жидкость | –86 | 82,5 | Неограниченная |
| Фенол | Твердое вещество | 41 | 182 | 9,3 г в 100 г Н2О при 25 °С |
Реакции спирта изопропанола (СН3)2СНОН
1. Реакция с соляной кислотой:
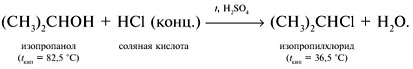
2. Внутримолекулярная дегидратация с образованием алкена:

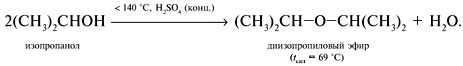
3. Межмолекулярная дегидратация с образованием простого эфира:
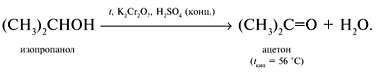
4. Окисление до кетона:
Реакции фенола С6Н5ОН
1. Образование соли фенолята натрия в реакции со щелочью:
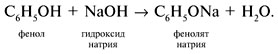
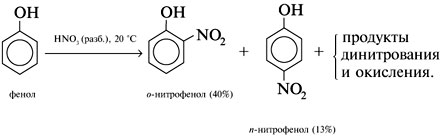
2. Нитрование в ароматическое бензольное кольцо:
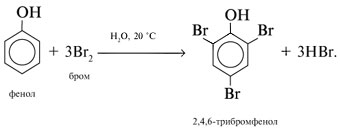
3. Галогенирование (бромирование) в бензольное кольцо:
4. Цветная реакция фенола с хлоридом железа(III) – фиолетовое окрашивание.
|
Действия при распознавании веществ (на примере уксусной кислоты) |
Задача 2. Как различить водные растворы фенола, этанола и уксусной кислоты?
Решение
Водные растворы каждого из предложенных
веществ имеют свой специфический запах –
фенольный, спиртовой и запах уксуса.
Универсальный бумажный индикатор в водной
уксусной кислоте показывает рН раствора 4–6.
Достаточно концентрированные растворы (![]() 50%) этанола и пары
уксусной кислоты при поджигании горят на
воздухе. При упаривании растворы этанола и
кислоты не дают остатка. После упаривания
водного раствора фенола и охлаждения выделяются
розовые кристаллы фенола (tпл(С6Н5ОН)
= 41 °С).
50%) этанола и пары
уксусной кислоты при поджигании горят на
воздухе. При упаривании растворы этанола и
кислоты не дают остатка. После упаривания
водного раствора фенола и охлаждения выделяются
розовые кристаллы фенола (tпл(С6Н5ОН)
= 41 °С).
При добавлении соды Na2CO3 или пищевой
соды NaHCO3 к каждому из растворов только в
одном случае – с уксусной кислотой –
наблюдается выделение пузырьков газа:
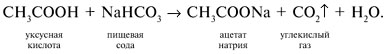
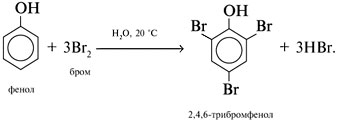
При добавлении бромной воды к раствору фенола образуется белый осадок нерастворимого в воде 2,4,6-трибромфенола:
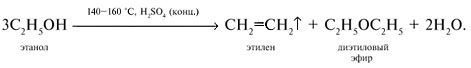
Кипячение водного этанола (> 50%) с концентрированной серной кислотой сопровождается внутри- и межмолекулярной дегидратацией с образованием газа этилена и легкокипящего диэтилового эфира:
Задача 3. 1 моль некоторого
органического вещества присоединяет лишь
1 моль брома. При нагревании этого вещества с
гидроксидом меди(II) образуется осадок красного
цвета. Установите формулу вещества, если
известно, что при сжигании 1,12 г этого вещества
было получено 2,64 г углекислого газа и 0,72 г воды.
Решение
Из условия можно предположить, что искомое вещество содержит две функциональные группы – непредельную связь и альдегидную группу. Общая формула кислородсодержащего соединения – СхНyОz. Соотношение индексов:
x:y:z = [m(C)/M(C)]:[m(H)/M(H)]:[m(O)/M(O)]
= ![]() (C):
(C):![]() (H):
(H):![]() (O).
(O).
Рассчитаем количества веществ продуктов
горения по формуле ![]() = m/М:
= m/М:
![]() (СО2)
= 2,64/44 = 0,06 моль,
(СО2)
= 2,64/44 = 0,06 моль, ![]() (Н2О)
= 0,72/18 = 0,04 моль.
(Н2О)
= 0,72/18 = 0,04 моль.
Количества веществ элементов С и Н в исходном соединении такие:
![]() (С) =
(С) = ![]() (СО2) = 0,06 моль,
(СО2) = 0,06 моль, ![]() (Н) = 2
(Н) = 2![]() (Н2О) = 0,08 моль,
(Н2О) = 0,08 моль,
что соответствует массам:
m(С) = 0,06•12 = 0,72 г, m(Н) = 0,08•1 = 0,08 г.
Содержание кислорода по массе в определяемом веществе:
1,12 – 0,72 – 0,08 = 0,32, г,
или в молях:
![]() (О) =
0,32/16 = 0,02 моль.
(О) =
0,32/16 = 0,02 моль.
Найдем соотношение чисел атомов С, Н и О в молекуле СхНyОz, т.е. индексы в химической формуле:
x:y:z = 0,06:0,08:0,02 = 3:4:1.
Простейшей молекулярной формуле С3Н4О1
отвечает структурная формула СН2=СНСНО, это
– акролеин.
Ответ. Формула вещества – СН2=СНСНО.
Задача 4. Органическое вещество А массой 7,2 г присоединяет бромоводород. Продукт реакции под действием оксида серебра переходит в соединение, которое при осторожном окислении образует 10,4 г твердого вещества Б. Вещество Б при нагревании выше температуры плавления разлагается, образуя летучую кислоту массой 6,0 г (в составе которой 40% углерода, 6,7% водорода, 53,3% кислорода) и 4,4 г газа с содержанием кислорода 72,72% по массе. Определите вещество А и напишите уравнения указанных реакций.
Решение
Составим план решения задачи.
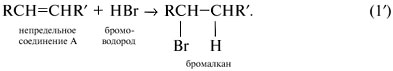
Скорее всего А – непредельное соединение RСН=СНR',
и продуктом присоединения к нему бромоводорода
(реакция 1') будет бромалкан:
Оксид серебра обычно упоминается в задачах как слабый окислитель, используемый для превращения альдегидной группы СНО в карбоксильную группу СООН, т.е. в реакции (2') R' = СНО:
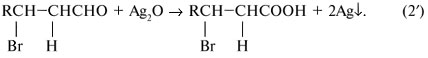
Непонятной остается фраза, относящаяся к
третьей реакции: «При осторожном окислении…
образует твердое вещество Б». Во-первых, какой
атом окисляется? Во-вторых, что представляет
собой твердое вещество Б? Поэтому реакцию (3') мы
пока пропускаем.
Ключ к решению дает четвертая реакция:
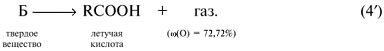
Газ с ![]() (О) = 72,72% –
это СО2, М(СО2) = 44 г/моль. Летучая
кислота общей формулы СхНyОz
имеет следующее соотношение индексов:
(О) = 72,72% –
это СО2, М(СО2) = 44 г/моль. Летучая
кислота общей формулы СхНyОz
имеет следующее соотношение индексов:
x:y:z = [![]() (C)/М(С)]:[
(C)/М(С)]:[![]() (Н)/М(Н)]:[
(Н)/М(Н)]:[![]() (О)/М(О)] = (40/12):(6,7/1):(53,3/16) = 3,33:6,7:3,33 = 1:2:1.
(О)/М(О)] = (40/12):(6,7/1):(53,3/16) = 3,33:6,7:3,33 = 1:2:1.
Простейшая формула вещества – СН2О. Это альдегид, а не кислота. Удвоенная простейшая формула С2Н4О2 соответствует уксусной кислоте СН3СООН, М = 60 г/моль. Количества веществ продуктов реакции и исходного вещества в реакции (4'):
![]() (СН3СООН)
= m/M = 6/60 = 0,1 моль,
(СН3СООН)
= m/M = 6/60 = 0,1 моль,
![]() (СО2) = 4,4/44 = 0,1
моль,
(СО2) = 4,4/44 = 0,1
моль, ![]() (Б) = 0,1 моль.
(Б) = 0,1 моль.
Молярная масса вещества Б: М = m/![]() = 10,4/0,1 = 104 г/моль, его
молекулярная формула – С3Н4О4.
Это дикарбоновая малоновая кислота НООССН2СООН
(tпл = 135 °С).
= 10,4/0,1 = 104 г/моль, его
молекулярная формула – С3Н4О4.
Это дикарбоновая малоновая кислота НООССН2СООН
(tпл = 135 °С).
При нагревании выше температуры плавления
малоновая кислота разлагается с выделением
углекислого газа и образованием уксусной
кислоты:
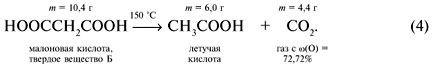
Еще раз проанализировав условие задачи, можно догадаться, что исходное вещество А – акриловая кислота, и реакция (1) имеет вид:

Реакция (2) состоит в замещении атома брома в 3-бромпропионовой кислоте на гидроксильную группу воды с осаждением бромида серебра:
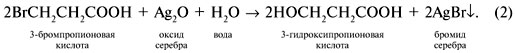
Окисление спиртового углерода 3-гидроксипропионовой кислоты дает малоновую кислоту (реакция 3):

Ответ. Вещество А – акриловая кислота СН2=СНСООН.
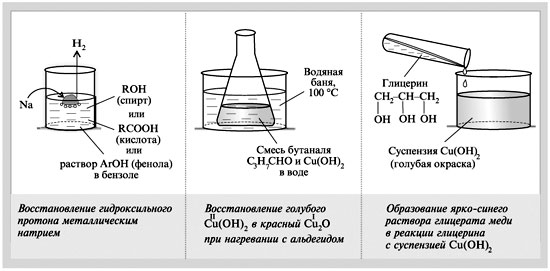 |
Качественные реакции кислородсодержащих органических соединений |
УПРАЖНЕНИЯ
1. Как химическим способом различить следующие вещества: 2-гидроксипропановая кислота, нитробензол, 2-хлорфенол, циклогексен? Опишите последовательность проведения химических реакций, составьте их уравнения и укажите признаки реакций.
2. В четырех пробирках без надписей находятся: пропиловый спирт, гексен-1, глицерин и разбавленная серная кислота. Приведите уравнения химических реакций, с помощью которых можно однозначно охарактеризовать каждое из приведенных в условии задачи веществ.
3. В трех пробирках находятся следующие вещества: пропионовая кислота, пропионовый альдегид, диметилкетон. С помощью какого одного реактива можно различить эти вещества? Напишите уравнения реакций.
4. Вещество Х вступает в реакции с гидроксидом калия и аммиачным раствором оксида серебра(I), но не реагирует с бромоводородом. Какое это может быть вещество? (приведите хотя бы один пример.) Ответ поясните. Напишите уравнения реакций.
5. Вещество С7Н8О не дает окрашивания с хлорным железом, не растворяется в водной щелочи, при окислении образует бензойную кислоту. Что это за соединение?
6. Как из толуола получить пара- и мета-нитробензойные кислоты?
7. Как, исходя из ацетилена, получить этилацетат? Напишите уравнения реакций этилацетата с: а) водным раствором аммиака; б) водным раствором гидроксида калия; в) раствором этилата натрия в этаноле.
8. Любым способом идентифицируйте следующие вещества: бензол, формальдегид (40%-й водный раствор), уксусная кислота, ацетон, этилацетат, диэтиловый эфир, хлороформ СHCl3.
Ответы на упражнения к теме 2
Урок 28
1. Чтобы различить вещества (все они жидкости):
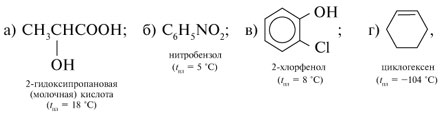
следует в каждое из них опустить влажную полоску бумажного универсального индикатора. В пробирке, где индикатор краснеет, – кислота а). При добавлении к кислоте раствора соды выделяются пузырьки углекислого газа:
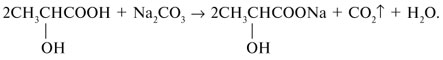
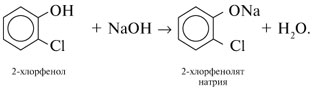
При добавлении к трем оставшимся веществам б), в), г) раствора NaOH (малинового цвета в присутствии фенолфталеина) будем наблюдать следующее. Водный NaOH не смешивается с органическими жидкостями б), г) и не изменяет свою окраску. С хлорфенолом щелочь дает однородный раствор, причем малиновая окраска исчезает:
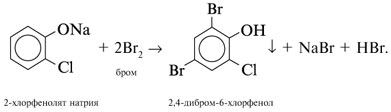
При добавлении к водному 2-хлорфеноляту натрия
бромной воды выпадает осадок
2,4-дибром-6-хлорфенола:
Желтая бромная вода обесцвечивается при добавлении циклогексена:
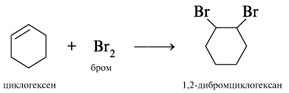
Нитробензол экстрагирует окраску из водного Вr2.
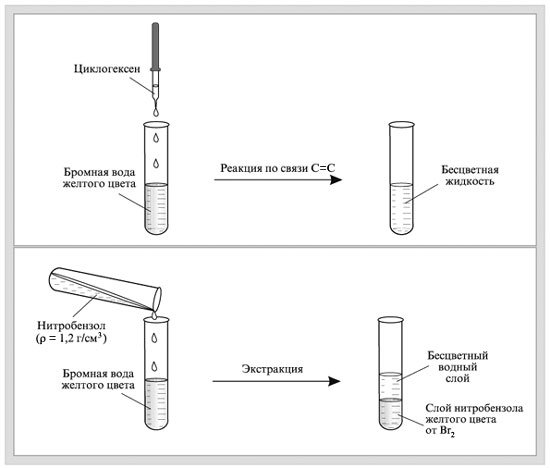 |
Присоединение Br2 по кратной
связи циклогексена и
|
2. Различение веществ:
удобно начать с оценки кислотности веществ. Универсальный бумажный индикатор (или синий лакмус) при смачивании веществами а)–в) не изменяет окраску, а от кислоты Н2SO4 краснеет. Цинк выделяет из разбавленной кислоты водород:
H2SO4 (разб.) + Zn = ZnSO4 + H2![]() .
.
При добавлении гексена-1 к разбавленному раствору марганцовки малиновая окраска быстро исчезает и выпадает немного черного осадка МnО2:

Глицерин и пропанол-1 при 20 °С с разбавленным
раствором КМnО4 не реагируют.
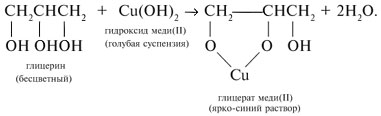
Глицерин с водной суспензией
свежеприготовленного Cu(ОН)2 дает ярко-синее
окрашивание:
Спирт а) при нагревании с концентрированной серной кислотой дегидратируется с выделением газообразного пропилена:
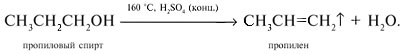
3. Вещества 
можно различить с помощью реагента Cu(ОН)2. Добавим в каждую из трех пробирок суспензию свежеприготовленного Cu(OH)2. В пропионовой кислоте гидроксид растворится вследствие реакции нейтрализации:
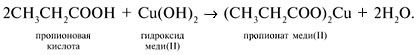
При нагревании двух других пробирок в одной из них происходит реакция восстановления альдегидной группы. При этом голубой цвет реакционной смеси сменяется на красный (от Cu2О):
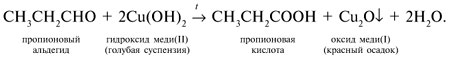
Карбонильная группа диметилкетона не окисляется слабым окислителем Cu(OH)2.
4. Веществом Х может быть, например: а) муравьиная кислота НСООН; б) 3-хлорпропаналь СlСН2СН2СНО. Уравнения реакций:
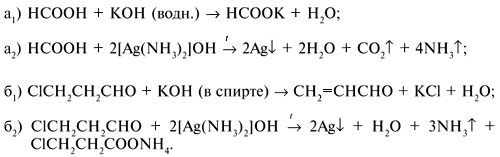
5. Фиолетовое окрашивание с хлорным
железом – качественная реакция на фенолы. Если с
заданным веществом окрашивания нет и к тому же
вещество не растворяется (как фенолы) в водной
щелочи, значит, это не фенол.
Изомерный фенолам класс веществ – ароматические
спирты. Химическая формула вещества состава С7Н8О,
при окислении которого получается бензойная
кислота С6Н5СООН, – бензиловый спирт
С6Н5СН2ОН.
6. Чтобы из толуола получить
нитробензойную кислоту, необходимы две реакции
– окисление метильной группы СН3 в
карбоксильную СООН и нитрование бензольного
кольца.
В зависимости от последовательности их
выполнения: а) сначала нитрование, потом
окисление или б) окисление и затем нитрование –
получают пара- (а) или мета-нитробензойную
кислоту (б):
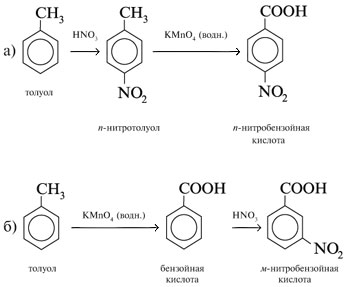
7. Схема получения этилацетата из ацетилена:
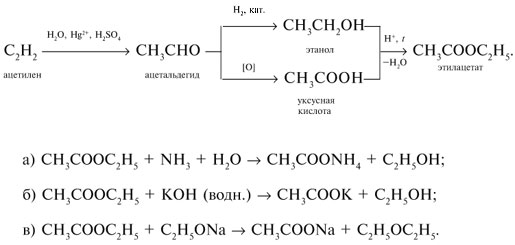
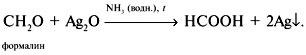
8. Понемногу каждого вещества поместим в пробирки и добавим воды. Формалин (40%-й раствор формальдегида), уксусная кислота и ацетон растворяются в воде. Бензол, этилацетат и диэтиловый эфир образуют органический слой над водой. Хлороформ тяжелее воды; не смешивающийся с водой слой хлороформа находится под водой. Обратим внимание, что формальдегид щиплет глаза (лакриматор) и он дает реакцию «серебряного зеркала»:
Уксусная кислота (уксус) изменяет окраску синего лакмуса в красный цвет, кроме того, уксус имеет запах маринада и выделяет пузырьки газа СО2 при реакции с карбонатами, например с содой:
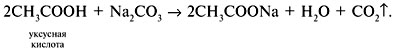
У ацетона сладковатый запах, ацетоном часто
снимают лак с ногтей и растворяют нитрокраски,
температура кипения ацетона равна 56 °С.
Не смешивающиеся с водой вещества различим по их
температурам кипения: бензол (tкип =
80 °С), этилацетат (tкип = 77 °С),
диэтиловый эфир (tкип = 34,6 °С).
Из-за близости температур кипения бензола и
этилацетата для идентификации этих жидкостей
воспользуемся тем, что у них весьма различные
температуры плавления. Если поместить склянки с
этими веществами в морозильную камеру
холодильника, то скоро бензол (tпл =
5 °С) замерзнет, а этилацетат (tпл =
–84 °С) останется жидким. Вдобавок бензол и
этилацетат по-разному ведут себя при кипячении с
разбавленной соляной кислотой. Бензол при этом
остается неизменным, а этилацетат гидролизуется:
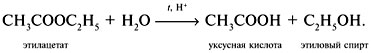
Каждое из образующихся при гидролизе веществ –
СН3СООН и С2Н5ОН –
неограниченно растворимо в воде, т.е. после
кипячения этилацетата с кислотой и охлаждения
смесь станет однородной. Исчезнет граница
раздела фаз – органической и водной.
Итак, на основании физических свойств
органических веществ: а) растворимости в воде,
б) плотности (![]() < 1
г/мл и
< 1
г/мл и ![]() > 1 г/мл)
несмешивающихся с водой жидкостей, в)
характерного запаха, г) температур кипения и
плавления, – а также с использованием химических
свойств: д) по действию на индикаторы, е) по
качественным реакциям на функциональные группы
– можно распознать и различить многие
соединения.
> 1 г/мл)
несмешивающихся с водой жидкостей, в)
характерного запаха, г) температур кипения и
плавления, – а также с использованием химических
свойств: д) по действию на индикаторы, е) по
качественным реакциям на функциональные группы
– можно распознать и различить многие
соединения.