УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК ЗАДАЧНИК ЗАДАЧНИК ЛАБОРАТОРНЫЙ ПРАКТИКУМ ЛАБОРАТОРНЫЙ ПРАКТИКУМ НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3,
4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28,
29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43/2003
§ 6.3. Сильные и слабые электролиты
(продолжение)
Задачи и вопросы
1. Рассчитайте концентрации ионов в
0,01М растворе следующих сильных кислот:
хлороводородной (соляной) НCl, азотной НNО3,
хлорной НСlО4.
2. Считая в разбавленном растворе
серную кислоту Н2SО4 сильным
электролитом при диссоциации по первой ступени,
напишите уравнение диссоциации серной кислоты
по первой ступени и вычислите концентрации ионов
водорода и гидросульфат-ионов 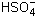 в 0,01М растворе серной кислоты. в 0,01М растворе серной кислоты.
3. Считая в разбавленном растворе
фосфорную кислоту Н3РО4 сильным
электролитом при диссоциации по первой ступени,
напишите уравнение диссоциации фосфорной
кислоты по первой ступени и вычислите
концентрации ионов водорода и
дигидрофосфат-ионов 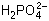 в 0,01М растворе фосфорной кислоты. в 0,01М растворе фосфорной кислоты.
4. Рассчитайте концентрации ионов
натрия и калия в 0,01М растворе гидроксида натрия
NаОН и гидроксида калия КОН.
5. Рассчитайте концентрации ионов в
0,002М растворе гидроксида кальция Са(ОН)2.
6. Рассчитайте концентрации ионов в
0,01М растворе следующих солей: хлорид натрия NaCl,
хлорид кальция СаCl2, хлорид алюминия AlCl3,
сульфат натрия Na2SO4, фосфат натрия Na3PO4,
хлорид железа FeCl3, сульфат железа Fe2(SO4)3,
хлорид аммония NH4Сl, сульфат аммония (NH4)2SO4,
фосфат аммония (NН4)3РО4, ацетат
натрия NаСН3СОО, ацетат кальция Са(СН3СОО)2.
7. Рассчитайте концентрации ионов в
растворе, содержащем 0,1 моль/л соляной кислоты
и 0,01 моль/л хлорида натрия.
8. Рассчитайте концентрации ионов в
растворе, содержащем 0,01 моль/л сульфата алюминия
Аl2(SO4)3 и 0,001 моль/л хлорида
алюминия AlCl3.
9. В мерную колбу на 1000 мл насыпали 1 г
хлорида натрия, 2 г сульфата натрия и прилили воды
до метки. Рассчитайте концентрации ионов в
растворе.
10. В мерную колбу на 1000 мл насыпали 1 г
медного купороса (пятиводный сульфат меди) CuSO4•5H2О
и прилили воды до метки. Каковы концентрации
ионов в полученном растворе?
11. В мерную колбу на 250 мл насыпали 1 г
медного купороса (пятиводный сульфат меди) CuSO4•5H2О,
2 г сульфата натрия Na2SO4, 3 г сульфата
калия К2SО4 и прилили воды до метки.
Каковы концентрации ионов в полученном растворе?
12. В мерную колбу на 500 мл насыпали 1 г
медного купороса (пятиводный сульфат меди) CuSO4•5Н2О,
2 г сульфата натрия Na2SO4, 3 г сахарозы
(сахар) и прилили воды до метки. Каковы
концентрации ионов в полученном растворе?
13. Переведите на русский язык.
In 1877 one of the scientific periodicals carried an article by Arrhenius entitled
«Dissociation of Substances Dissolved in Water». In this article Arrhenius presented the
results of his investigations on the electrical conductivity of solutions. According to
Arrhenius the electrical conductivity of electrolytes was due to dissociation of their
molecules into electrically charged particles which he called ions. This term was first
used by Faraday in slightly different sense.
The assumptions put forth by Arrhenius in the above-mentioned article were subsequently
developed in integral theory known as the Theory of Electrolytic Dissociation or the
Ionization Theory.
The main theses of this theory are as follows. When electrolytes are dissolved in water
their molecules break up to a greater or lesser degree into ions, i.e., electrically
charged particles. Each substance forms two kinds of ions, carrying positive and negative
charges respectively. The positively charged ions of acids, bases and salts are those of
hydrogen and metals, while the negatively charged ions are acid and hydroxyl radicals.
The total number of positive charges acquired by one kind of ions equals the total number
of negative charges on the ions of the other kind, so that the solution as a whole remains
electrically neutral.
The difference between ions on the one hand and neutral atoms and molecules on the other,
is that the former possess electrical charges, but this makes their properties absolutely
different.
О.С.ЗАЙЦЕВ
|