УЧЕБНАЯ КНИГА ПО ХИМИИДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
|
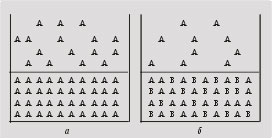 |
Рис. 6.5.
|
Введем коэффициент пропорциональности
kисп (учитывающий природу вещества А и
другие факторы) и напишем знак равенства: ![]() исп = kисп
• S.
исп = kисп
• S.
Скорость процесса обратного перехода вещества А
из газообразного состояния в жидкость, т. е.
конденсации ![]() конд,
пропорциональна площади поверхности жидкости S,
доступной для перехода молекул из газовой фазы в
жидкую, и числу молекул в некотором объеме
газовой фазы над поверхностью жидкости, т. е.
пропорциональна давлению пара жидкости рА:
конд,
пропорциональна площади поверхности жидкости S,
доступной для перехода молекул из газовой фазы в
жидкую, и числу молекул в некотором объеме
газовой фазы над поверхностью жидкости, т. е.
пропорциональна давлению пара жидкости рА:
![]() конд ~ S,
конд ~ S,
![]() конд ~ рА.
конд ~ рА.
Помня, что величина, пропорциональная нескольким
факторам, пропорциональна произведению этих
факторов, и введя коэффициент
пропорциональности kконд, получаем:
![]() конд
= kконд • S • рА.
конд
= kконд • S • рА.
При равенстве скоростей прямого и обратного процессов (испарения и конденсации):
![]() исп
=
исп
= ![]() конд, kисп
• S = kконд • S • рА,
конд, kисп
• S = kконд • S • рА,
наступает состояние равновесия, характеризующееся константой равновесия К:
К = kисп/kконд,
для которой площадь поверхности жидкой фазы не имеет значения, поэтому
К = рА.
Следовательно, константа равновесия процесса перехода вещества из жидкой фазы в газообразную численно равна давлению насыщенного пара при данной температуре.
Пример. При температуре 20 °С давление
водяного пара над чистой жидкой водой составляет
![]()
Обратите внимание: константа равновесия имеет размерность!
Тот же подход используем для описания
поведения и свойств раствора, состоящего из
растворителя А и растворенного вещества В. При
растворении вещества В в веществе А число
молекул А в единице объема жидкости уменьшается,
а значит, снижается и их число, приходящееся на
единицу поверхности испаряющейся жидкости (рис.
6.5, б). Из-за этого уменьшается скорость испарения
растворителя (воды) и снижается давление
(парциальное) насыщенного пара растворителя над
раствором.
Для обсуждения свойств растворов нам необходимо
познакомиться с еще одним способом выражения
концентрации – мольными долями (или
мольными процентами).
Этот способ выражения концентрации используется в тех случаях, когда требуется показать зависимость какого-либо свойства системы от ее состава. Поскольку состав может быть выражен набором концентраций всех ее компонентов, то нахождение зависимости свойства системы от ее состава и объяснение результатов оказывается не только трудным, но часто и невозможным делом. Использование мольных долей дает то преимущество, что их сумма равна единице, и, таким образом, концентрации компонентов системы оказываются взаимосвязанными. В ряде социологических и экологических исследований используется подобный подход, хотя сами исследователи об этом часто не догадываются.
Мольная доля Ni компонента i
равна отношению числа молей ni этого
компонента к сумме молей
Ni = ni / (n1 + n2 + … + ni + … + nk).
Сумма мольных долей всех компонентов системы
(раствора) равна единице.
Ниже мы будем говорить только о двукомпонентных
системах – растворах, состоящих из растворителя
А и растворенного вещества В. Мольная доля А в
таком растворе равна
NА = nА / (nА + nВ).
Мольная доля В равна
NВ = nВ / (nА + nВ).
Убедитесь, что сумма мольных долей
компонентов А и В равна 1.
Обозначим мольную долю растворителя через NA
и растворенного вещества – NB. Доля
поверхности, доступной для испарения
растворителя, – SA равна произведению
площади поверхности S раствора на мольную
долю растворителя NA:
SA = S • NA.
Скорости испарения и конденсации растворителя равны:
![]() исп
= kисп • S • NA,
исп
= kисп • S • NA, ![]() конд = kконд
• S • рА.
конд = kконд
• S • рА.
При равновесии, когда скорости испарения и конденсации равны, имеем:
kисп • S • NA = kконд • S • рА.
Отношение kисп/kконд есть константа равновесия:
К = рА/NA.
Откуда рА = К • NA.
В полученном выражении константа равновесия К
играет роль коэффициента пропорциональности
между парциальным давлением растворителя рА
и его мольной долей NA в растворе.
Численное значение коэффициента К определяется
подстановкой в это выражение значения давления
пара рА при данной мольной доле NA.
Если мольная масса растворителя равна единице (NA
= 1), то имеется чистый растворитель, давление
насыщенного пара которого при данной
температуре равно ![]() .
Следовательно, для чистого растворителя
коэффициент К есть его давление пара, т. е. К =
.
Следовательно, для чистого растворителя
коэффициент К есть его давление пара, т. е. К =
![]() . Подставляя это
значение коэффициента К в последнее соотношение,
получаем:
. Подставляя это
значение коэффициента К в последнее соотношение,
получаем:
![]()
Это – выражение закона Рауля (сформулирован в
1887 г.): парциальное давление насыщенного пара
растворителя над раствором прямо
пропорционально его мольной доле.
Вам здесь встретилось выражение «насыщенный
пар». Объясните, что оно означает.
Пример. Изменение содержания растворителя
в два раза должно привести к изменению его
давления насыщенного пара также в два раза.
Закон Рауля справедлив для идеального газа и
идеального раствора. Газ (или насыщенный пар)
ведет себя как идеальный газ, если он точно
подчиняется закону Клапейрона–Менделеева
(рV = nRT), или, что то же, 1 моль такого газа при
нормальных условиях (Т = 273 К или t = 0 °С, р
= 101 325 Па или 1 атм) имеет объем 22,4 л. Идеальный
раствор – это раствор, в котором силы всех
межмолекулярных взаимодействий молекул
растворителя и растворенных веществ одинаковы.
На свойства такого раствора не влияет, находится
ли молекула некоторого компонента в окружении
собственных молекул или молекул других
компонентов. Идеальный раствор образуется без
выделения или поглощения теплоты (![]() = 0). При образовании
идеального раствора его объем в точности равен
объемам смешиваемых компонентов. Частицы
каждого компонента в идеальном растворе ведут
себя независимо от присутствия частиц других
компонентов.
= 0). При образовании
идеального раствора его объем в точности равен
объемам смешиваемых компонентов. Частицы
каждого компонента в идеальном растворе ведут
себя независимо от присутствия частиц других
компонентов.
В природе не существует ни идеальных газов, ни
идеальных растворов. Газы гелий и неон весьма
близки к идеальным газам. Чем выше температура и
ниже давление, тем поведение газа ближе к
поведению идеального газа. Раствор тем ближе к
идеальному раствору, чем он разбавленнее.
Давление насыщенного пара растворителя над
идеальным раствором меньше, чем над чистым
растворителем. Чем выше мольная доля (или
концентрация) растворенного вещества, тем ниже
давление насыщенного пара растворителя.
Если мы измерим давление пара чистой воды при
температуре 20 °С, то оно окажется равным