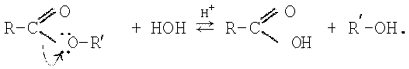
Цели.
РҐРѕРґ СѓСЂРѕРєР°
Слово «гидролиз» буквально означает «разложение водой». Гидролизом называется всякое взаимодействие вещества с водой обменного характера, при котором составные части вещества соединяются с составными частями воды. Например, сложные эфиры разлагаются водой с образованием смеси кислоты и спирта:
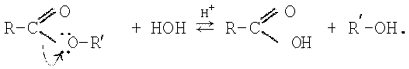
Хлорид фосфора(III) подвергается гидролизу, образуя фосфористую и соляную кислоты:
На практике особенно часто приходится иметь дело с гидролизом солей. Естественно предположить, что растворы средних солей, которые являются продуктами полного замещения протонов в молекулах кислот катионами металла, должны иметь нейтральную реакцию среды. Однако это предположение оказывается справедливым только в отношении солей, образованных сильными кислотами и сильными основаниями.
Соли, образованные слабой кислотой и сильным основанием или, наоборот, сильной кислотой и слабым основанием, не дают при растворении в воде нейтральной реакции среды. Например, раствор хлорида железа(III) дает кислую реакцию среды, указывающую на присутствие ионов водорода (ионов гидроксония); раствор карбоната натрия имеет щелочную среду, обусловленную присутствием в нем гидроксид-ионов.
Если соль образована слабой кислотой и слабым основанием, то реакция раствора зависит от относительной силы образующихся в результате гидролиза кислоты и основания. Например, из двух слабых электролитов, образующих цианид аммония, менее слабым электролитом является гидроксид аммония, что подтверждается значениями констант диссоциации: Кд(NH4OH)=1,79•10–5; Кд(HCN) = 7,90•10–10. Значит, раствор цианида аммония будет слабощелочным. Раствор ацетата аммония будет нейтральным, т. к. константы диссоциации уксусной кислоты и гидроксида аммония почти одинаковы: Кд(CH3COOH)=1,86•10–5; Кд(NH4OH) = 1,79•10–5.
Рти явления можно объяснить взаимодействием РёРѕРЅРѕРІ растворенной соли СЃ диполями РІРѕРґС‹, РІ результате которого образуется избыток водородных РёРѕРЅРѕРІ (РёРѕРЅС‹ РіРёРґСЂРѕРєСЃРѕРЅРёСЏ) или РіРёРґСЂРѕРєСЃРёРґ-РёРѕРЅРѕРІ.
Обратимая реакция обмена между ионами растворенной соли и ионами воды, приводящая к образованию малодиссоциированных частиц (молекулы или ионы), носит название гидролиза соли.
Количественно гидролиз солей может быть охарактеризован степенью гидролиза и константой гидролиза.
Константа гидролиза и степень гидролиза
1. Соль, образованная слабой кислотой и сильным основанием. Уравнение гидролиза соли ацетата натрия в молекулярной форме:
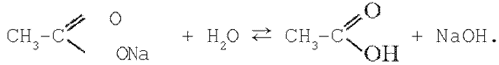
В ионной форме уравнение имеет вид:
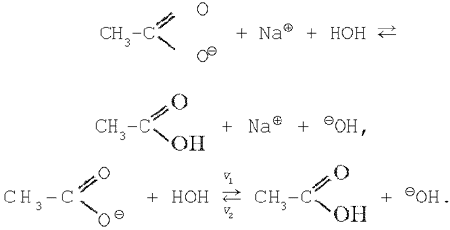
Применяя к этому обратимому процессу закон действующих масс, запишем выражения для скоростей прямой и обратной реакций:
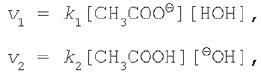
где k1 и k2 – константы скорости прямой и обратной реакций соответственно.
Как и любой другой обратимый процесс, реакция гидролиза заканчивается установлением химического равновесия, т. е. такого состояния системы, когда скорости прямой и обратной реакций равны: v1 = v2.
Откуда
![]()
Константа химического равновесия К равна отношению константы скорости прямой реакции к константе скорости обратной реакции.
Таким образом,
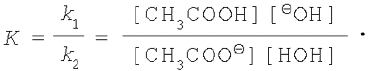
Концентрацию воды в растворе допускается считать величиной постоянной, поэтому объединим [НОН] и К.
где Кг – константа гидролиза.
Рзвестно, что
![]()
где К(H2O) – ионное произведение воды.
Подставляя выражение для ![]() в уравнение константы гидролиза
(1), получим:
в уравнение константы гидролиза
(1), получим:
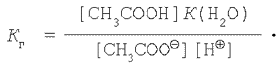
Однако
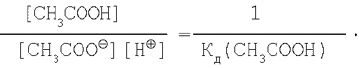
Тогда окончательно имеем:
![]()
Степенью гидролиза b называется отношение количества гидролизованной соли к общему количеству растворенной соли.
Определим степень гидролиза соли, образованной слабой кислотой и сильным основанием. Пусть в реакции гидролиза соли ацетата натрия начальная концентрация ее, а значит, и ацетат-ионов (т. к. соль – сильный электролит) равна с. Тогда равновесные концентрации примут значения:
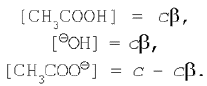
Подставим эти выражения в уравнение константы гидролиза (1):
![]()
Воспользовавшись уравнением (2), получим:
![]()
Для многих солей b – величина небольшая (обычно b<<0,01), поэтому с известным приближением можно принять 1–b»1. Тогда уравнение (3) примет вид:
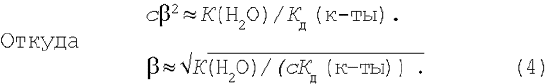
2. Соль, образованная сильной кислотой и слабым основанием. Уравнение гидролиза соли хлорида аммония в молекулярной форме:
![]()
В ионной форме уравнение имеет вид:
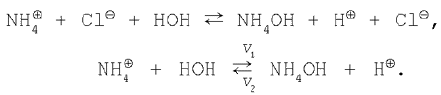
Применяя закон действующих масс, запишем:
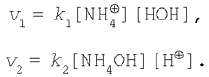
В состоянии химического равновесия v1=v2, поэтому
![]()
Откуда
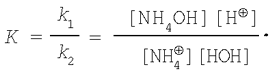
Объединяя [НОН] и К, получим:
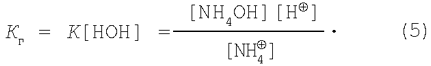
Рзвестно, что ![]()
Подставим это выражение в уравнение (5) и получим:
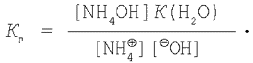
Зная, что
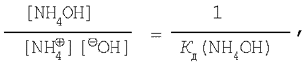
имеем окончательное выражение:
![]()
Выведем уравнение для степени гидролиза соли, образованной слабым основанием и сильной кислотой.
Пусть в реакции гидролиза соли хлорида аммония ее начальная концентрация, а значит, и концентрация катионов аммония (т. к. соль – сильный электролит) равна с. Тогда равновесные концентрации приобретут значения:
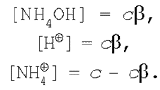
Подставим эти выражения в уравнение для константы гидролиза (5):
![]()
Воспользовавшись уравнением (6), получим:
![]()
Допустив, что 1–b»1, преобразуем уравнение (7):
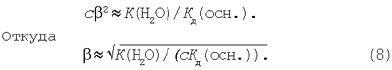
3. Соль, образованная слабой кислотой и слабым основанием. Уравнение гидролиза соли цианида аммония в молекулярной и ионной формах:
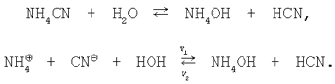
Применим закон действующих масс к данному обратимому процессу:
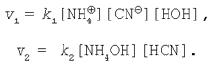
В состоянии химического равновесия cкорость прямой реакции равна скорости обратной реакции:
![]()
Константа химического равновесия – это отношение константы скорости прямой реакции к константе скорости обратной реакции:
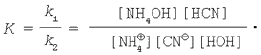
Как и в предыдущих случаях, объединим K и [НОН]:
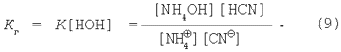
Умножим числитель и знаменатель в уравнении (9) на величину ионного произведения воды:
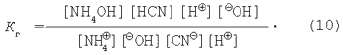
Зная, что
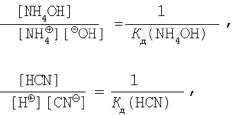
преобразуем выражение для константы гидролиза (10).
В результате получим:
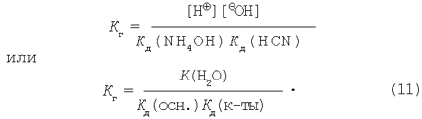
Выразим степень гидролиза соли, образованной слабой кислотой и слабым основанием.
Пусть исходная концентрация соли цианида аммония РІ реакции гидролиза равна СЃ. Рсходные концентрации катиона аммония Рё цианид-аниона также можно считать равными СЃ (РїРѕРјРЅСЏ, что соль – сильный электролит). РўРѕРіРґР° равновесные концентрации РїСЂРёРјСѓС‚ значения:
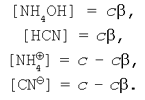
Подставляя выражения равновесных концентраций в уравнение константы гидролиза (9) получим:
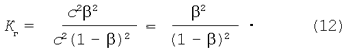
Приравниваем правые части уравнений (11) и (12):
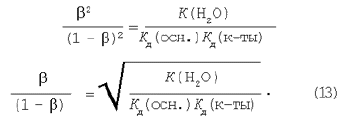
РР· уравнений (4), (8), (13) следует, что степень гидролиза тем больше:
Например, РїСЂРё добавлении Рє раствору хлорида СЃСѓСЂСЊРјС‹(III) дистиллированной РІРѕРґС‹ наблюдается образование осадка SbOCl, что свидетельствует Рѕ протекании реакции гидролиза соли SbCl3 РїРѕ второй ступени. Рменно вторая ступень гидролиза хлорида СЃСѓСЂСЊРјС‹(III) РїСЂРёРІРѕРґРёС‚ Рє образованию РѕСЃРЅРѕРІРЅРѕР№ соли Sb(РћРќ)2РЎl, разложение которой Рё дает осадок хлорида РѕРєСЃРѕСЃСѓСЂСЊРјС‹.
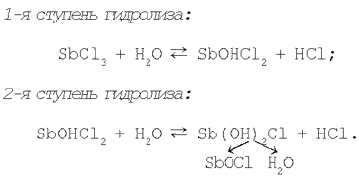
Таким образом, разбавляя раствор, смещаем равновесие реакции гидролиза вправо.
Если гидролиз – явление нежелательное, то работать следует с концентрированными растворами при пониженных температурах. Полезно также добавить к раствору соли избыток одного из образующихся при гидролизе продуктов (кислоты или щелочи, в зависимости от реакции среды раствора), тем самым способствуя смещению химического равновесия реакции влево в соответствии с принципом Ле Шателье.
Так, если к раствору с осадком SbОСl прилить соляную кислоту, то осадок растворится. Если затем вновь в раствор добавить воду, то наблюдается повторное образование осадка.
Описанные явления согласуются с ранее сделанными выводами о влиянии разбавления раствора на степень гидролиза, а также подтверждают обратимый характер процесса и возможность смещения химического равновесия реакции гидролиза.